платиноиды, химические элементы второй и третьей триад VIII группы периодической системы Менделеева. К ним принадлежат: рутений (Ruthenium) Ru, родий (Rhodium) Rh, палладий (Palladium) Pd (лёгкие П. м., плотность Пл
атиновые мет
аллы12
г/см3)
; осмий (Osmium) Os, иридий (Iridium) lr, платина (Platinum) Pt (тяжёлые П. м., плотность Пл
атиновые мет
аллы22
г/см3)
. Серебристо-белые тугоплавкие
металлы; благодаря красивому внешнему виду и высокой химической стойкости П. м. наряду с Ag и Au называют благородными металлами (См.
Благородные металлы)
. Историческая справка. Имеются указания, что самородная платина в древности была известна в Египте, Эфиопии, Греции и Южной Америке. В 16 в. исп.
Конкистадоры обнаружили в Южной Америке вместе с самородным золотом очень тяжёлый белый тусклый
металл, который не удавалось расплавить. Испанцы назвали его платиной - уменьшительным от исп. plata - серебро. В 1744 исп. морские офицер Антонио де Ульоа привёз образцы Pt в Лондон. Они вызвали живой интерес учёных Европы. Самостоятельным металлом Pt, которую первоначально считали белым золотом, была признана в середине 18 в.
В 1803 английский учёный У. Х. Волластон обнаружил в самородной платине палладий, получивший это название от малой планеты Паллады (открытой в 1802), и родий, названный так по розовато-красному цвету его солей (от греч. rhódon - роза). В 1804 английский химик Смитсон Теннант в остатке после растворения самородной Pt в царской водке открыл ещё 2 металла. Один из них получил название иридий вследствие разнообразия окраски его солей (от греч. íris, род. падеж íridos - радуга), другой был назван осмием по резкому запаху его четырёхокиси (от греч. osmá - запах). В 1844 К. К.
Клаус при исследовании остатков от аффинажа (очистки) уральской самородной Pt в Петербургском монетном дворе открыл ещё один П. м. - рутений (от позднелат. Ruthenia - Россия).
С. А. Погодин.
Распространение в природе. П. м. принадлежат к наиболее редким элементам, их среднее содержание в земной коре (кларки) точно не установлено, ориентировочные значения приведены в таблице. Самые редкие в земной коре - Rh и lr (1․10
-7\% по массе), наиболее распространён Os (5․10
-6\%). Содержание П. м. повышено в ультраосновных и основных изверженных породах, происхождение которых связано с глубинными магматическими процессами. К этим породам приурочены месторождения П. м. Ещё выше среднее содержание П. м. в каменных метеоритах, которые считаются аналогами средней мантии Земли (кларки П. м. в каменных метеоритах составляют
n․10
-4 - n․10
-5\% по массе). Для земной коры характерно самородное состояние П. м., а у Rh, Pd, Os и Pt известны также немногочисленные соединения с серой, мышьяком и сурьмой. Установлено около 30 минералов П. м., больше всего их у Pd (13) и Pt (9). Все минералы образовались на больших глубинах при высоких температурах и давлениях (см.
Платиновые руды, Платина самородная)
. Платина и другие П. м. встречаются в виде примеси во многих сульфидах и силикатах ультраосновных и основных пород. Геохимия П. м. в биосфере почти не изучена, их содержание в гидросфере и живом веществе не установлено. Некоторые осадочные марганцевые руды обогащены Pt (до 1․10
-3\%)
, в углях наблюдалась концентрация Pt и Pd (1․10
-6\%); повышенное содержание П. м. отмечалось в фосфоритах (вятских), в золе деревьев, растущих на месторождениях Pt.
А. И. Перельман.
Физические и химические свойства. Физические и механические свойства П. м. сопоставлены в таблице. В дополнение необходимо указать, что Ru и Os очень тверды и хрупки (возможно вследствие присутствия примесей). Rh и lr обладают меньшими твёрдостью и хрупкостью, а Pd и Pt ковки, поддаются прокатке, волочению, штамповке при комнатной температуре. Интересна способность некоторых П. м. (Ru, Pd, Pt) поглощать водород. Особенно это свойственно Pd, объём которого поглощает до 900 объёмов H2. При этом Pd сохраняет металлический вид, но растрескивается и становится хрупким. Все П. м. парамагнитны. Магнитная восприимчивость χs․10-6 электро-магнитных единиц при 18 °С равна 0,05 у Os; 0,50 у Ru; 5,4 у Pd; у Rh, lr и Pt она несколько более 1,0.
Согласно давно установившейся традиции, П. м. принято помещать в VIII группу периодической системы элементов (См.
Периодическая система элементов)
. В соответствии с этим следовало ожидать, что все П. м. должны иметь высшую степень окисления +8. Однако это наблюдается только у Ru и Os, прочие же П. м. проявляют валентность не выше +6. Объясняется это тем, что у атомов Ru и Os остаются незаполненными соответственно внутренние подуровни
4f и
5f. Поэтому для атомов Ru и Os возможно возбуждение не только с подуровней
5s и 6s на подуровни
5p и
6p, но и с подуровней
4d и
5d на подуровни
4f и
5f. Вследствие этого в атомах Ru и Os появляется по 8 непарных электронов и валентность +8. Электронные конфигурации атомов Rh, lr, Pd, Pt такой возможности не допускают. Поэтому в некоторых вариантах таблицы Менделеева эти элементы (а также Со и Ni) выносят за пределы VIII группы. Все П. м. легко образуют
Комплексные соединения, в которых имеют различные степени окисления и различные координационные числа. Комплексные соединения П. м., как правило, окрашены и очень прочны.
Химические свойства П. м. имеют много общего. Все они в компактном виде (кроме Os) малоактивны. Однако в виде т. н. черни (мелкодисперсного порошка) П. м. легко адсорбируют S, галогены и др. неметаллы. (Чернь обычно получают восстановлением П. м. из водных растворов их соединений.) Компактные Ru, Rh, Os, lr, будучи сплавлены с Pt, Zn, Pb, Bi, переходят в раствор при действии царской водки, хотя она не действует на эти П. м., взятые отдельно.
Семейство П. м. можно разделить на 3 диады (двойки), образованные двумя стоящими один под другим лёгким и тяжёлым П. м., а именно: Ru, Os; Rh, lr; Pd, Pt.
При нагревании с O2 и сильными окислителями Ru и Os образуют легкоплавкие кристаллы - четырёхокиси (тетроксиды) - оранжевую RuO4 и желтоватую OsO4. Оба соединения летучи, пары их имеют неприятный запах и весьма ядовиты. При действии восстановителей превращаются в низшие окислы RuO2 и OsO2 или в металлы. Со щелочами RuO4 образует рутенаты, например рутенат калия K2RuO по реакции:
RuO4 + 2KOH = K2RuO4 + 1/2O2 + H2O.
При действии хлора K2RuO4 превращается в перрутенат калия:
K2RuO4 + 1/2Cl2 = KRuO4 + KCI.
Четырёхокись OsO
4 даёт с KOH комплексное соединение K
2[OsO
4(OH)
2]. С фтором и др. галогенами Ru и Os легко реагируют при нагревании, образуя соединения типа RuF
3, RuF
4, RuF
5, RuF
6. Осмий даёт подобные же соединения, кроме OsF
3; существование OsF
8 не подтверждено. Весьма интересны комплексные соединения Ru с
Ксеноном
Xe [RuF
6] (канадский химик Н. Бартлетт, 1962), а также с молекулярным азотом - [(NO)(NH
3)
4 N
2Ru (NH
3)
4 NO] CI (советский химик Н. М. Синицын, 1962) и [Ru (NH
3)
5N
2] Cl
2 (канадский химик А. Аллен, 1965).
На компактные Rh и lr царская водка не действует. При прокаливании в O2 образуются окислы Rh2O3 и Ir2O3, разлагающиеся при высоких температурах.
Pd легко растворяется при нагревании в HNO3 и концентрированной H2SO4 с образованием нитрата Pd (NO3)2 и сульфата PdSO4. На Pt эти кислоты не действуют. Царская водка растворяет Pd и Pt, причём образуются комплексные кислоты - тетрахлоропалладиевая кислота H2[PdCl4] и гексахлороплатиновая - коричнево-красные кристаллы состава H2[PtCl6]․6H2O Из её солей наибольшее значение для технологии П. м. имеет хлороплатинат аммония (NH4)2[PtCl6] - светло-жёлтые кристаллы, малорастворимые в воде и почти не растворимые в концентрированных растворах NH4CI. При прокаливании они разлагаются по реакции:
При этом Pt получается в мелкораздробленном виде (т. н. платиновая губка, или губчатая платина).
Получение. Разделение П. м. и получение их в чистом виде очень сложно вследствие большого сходства их химических свойств; это требует большой затраты труда, времени, дорогих реактивов. Для получения чистой Pt исходные материалы - самородную платину, платиновые шлихи (тяжёлые остатки от промывки платиноносных песков), лом (негодные для употребления изделия из Pt и её сплавов) обрабатывают царской водкой при подогревании. В раствор переходят: Pt, Pd, частично Rh, lr в виде комплексных соединений H2[PtCl6], H2[PdCl4], Нз [RhCl6] и H2[IrCl6], а также Fe и Cu в виде FeClз и CuCl2. Нерастворимый в царской водке остаток состоит из осмистого иридия, хромистого железняка (FeCrO2), кварца и др. минералов.
Из раствора осаждают Pt в виде (NH
4)
2[PtCl
6] хлористым аммонием. Но чтобы в осадок вместе с Pt не выпал lr в виде аналогичного нерастворимого соединения (NH
4)
2[lrCl
6] (остальные П. м. NH
4Cl не осаждает), предварительно восстанавливают Ir (+4) до Ir (+3) (например, прибавлением сахара C
12H
22O
11 по способу И. И.
Черняева)
. Соединение (NH
4)
3[IrCl
6] растворимо и не загрязняет осадка.
Хлороплатинат аммония отфильтровывают, промывают концентрированным раствором NH4CI (в котором осадок практически не растворим), высушивают и прокаливают. Полученную губчатую платину спрессовывают, а затем оплавляют в кислородно-водородном пламени или в электрической печи высокой частоты. Из фильтрата, оставшегося после осаждения (NH4)2[PtCl6], и из осмистого иридия извлекают прочие П. м. путём сложных химических операций. В частности, для перевода в растворимое состояние нерастворимых в царской водке П. м. и осмистого иридия используют спекание с перекисями BaO2 или Na2O2. Применяют также хлорирование - нагревание смеси Pt-концентратов с NaCl и NaOH в струе хлора.
В результате аффинажа получают труднорастворимые комплексные соединения: гексахлорорутенат аммония (NH4)3[RuCl6], дихлорид тетрамминдиоксоосмия [OsO2(NH3)4] Cl2, хлорпентамминдихлорид родия [Rh (NH3)5CI] Cl2, гексахлороиридат аммония (NH4)2[lrCl6] и дихлордиаммин палладия [Pd (NH3)2] Cl2. Прокаливанием перечисленных соединений в атмосфере H2 получают П. м. в виде губки, например
[OsO2(NH3)4] Cl2 + 3H2 = Os + 2H2O + 4NH3 + 2HCI
[Pd (NH3)2] Cl2 + H2 = Pd + 2NH3 + 2HCI.
Губчатые П. м. сплавляют в вакуумной электрической печи высокой частоты.
Применяют и др. способы аффинажа, в частности основанные на использовании ионитов (См.
Иониты)
. Основным источником получения П. м. служат сульфидные медно-никелевые руды, месторождения которых находятся в СССР (Норильск, Красноярский край), Канаде (округ Садбери, провинция Онтарио), ЮАР и др. странах. В результате сложной металлургической переработки этих руд благородные
металлы переходят в т. н. черновые
металлы - нечистые
Никель и
Медь. П. м. собираются почти полностью в черновом Ni, a Ag и Au - в черновой Cu. При последующем электролитическом рафинировании Ag, Au и П. м. осаждаются на дне электролитической ванны в виде шлама, который отправляют на аффинаж.
Свойства платиновых металлов
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
| Свойство | Ru | Rh | Pd | Os | lr | Pt |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Атомный номер | 44 | 45 | 46 | 76 | 77 | 78 |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Атомная масса | 101,07 | 102,9055 | 11906,4 | 190,2 | 192,22 | 195,09 |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Среднее содержание в | (5·10-7) | 1·10-7 | 1·10-6 | 5·10-6 | 1·10-7 | 5·10-7 |
| земной коре, \% по массе | | | | | | |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Массовые числа природных | 96, 98, 99, 100, | 103 (100) | 102, 104, 105 | 184, 186, | 191 (38,5) | 190, 192 (оба слабо |
| изотопов (в скобках указано | 101,102 (31, 61), | | (22,23), 106 | 187, 188, | 193 (61,5) | радиоактивны), 194 |
| распространение | 104 | | (27,33), 108 | 189, 190 | | (32,9), 196(25,2), |
| | | | (26,71), 110 | (26,4), 192 | | 198 (7,19) |
| | | | (11,8) | (41,0) | | |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Кристаллическая решётка, | Гексагональ- | Гранецент- | Гранецент- | Гексаго- | Гране- | Гране- |
| параметры
в
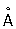
(при
20
°
| ная
плотнейшей
| рированная
| рирован-
| нальная
| центри-
| центри-
|
| С) | упаковки* | кубическая | ная | плотней- | рованная | рован- |
| | a =2,7057 | a =3,7957 | кубическая | шей | кубичес- | ная кубичес- |
| | c =4,2815 | | a =3,8824 | упаковки | кая | кая |
| | | | | a =2,7533 | a =3,8312 | a =3,916 |
| | | | | c =4,3188 | | |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Атомный радиус, Å | 1,34 | 1,34 | 1,37 | 1,36 | 1,36 | 1,39 |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Ионный радиус, Å (по Л. | Ru4+ 0,67 | Rh4+ 0,68 | Pd4+ 0,65 | Os4+ 0,65 | lr4+ 0,68 | Pt4+ 0,65 |
| Полингу) | | | | | | |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Конфигурация внешних | 4d75s1 | 4d85s1 | 4d10 | 5d66s2 | 5d76s2 | 5d96s1 |
| электронных оболочек | | | | | | |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Состояния окисления | 1,2,3,4,5,6,7,8 | 1,3,4 | 2,3,4 | 2,3,4,6,8 | 1,2,3,4,6 | 2,3,4 |
| (наиболее характерные | | | | | | |
| набраны полужирным | | | | | | |
| шрифтом) | | | | | | |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Плотность (при 20 °С), г/см3 | 12,2 | 12,42 | 11,97 | 22,5 | 22,4 | 21,45 |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Температура плавления, °С | 2250 | 1960 | 1552 | ок. 3050 | 2410 | 1769 |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Температура кипения, °С | ок. 4900 | ок. 4500 | ок. 3980 | ок. 5500 | ок. 5300 | ок. 4530 |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Линейный коэффициент | 9,1․10-6 (20°С) | 8,5․10-6 | 11,67․10-6 | 4,6․10-6° | 6,5․10-6 (0- | 8,9․10-6 |
| теплового расширения | | (0-100 °С) | (0°С) | | 100°С) | (0°С) |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Теплоёмкость, кал/(г ․°С) | 0,057 (0°C) | 0,059 | 0,058 (0°С) | 0,0309 (°С) | 0,0312 | 0,0314 (0°С) |
| | | (20 °C) | | | | |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| кдж/(кг ×К.) | 0,0312 | 0,247 | 0,243 | 0,129 | 0,131 | 0,131 |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Теплопроводность кал/(см ․ | - | 0,36 | 0,17 | - | - | 0,17 |
| сек °С) | | | | | | |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| вт/(м ․К) | - | 151 | 71 | - | - | 71 |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Удельное | 7,16-7,6 (0°C) | 4,7 (0°C) | 10,0 (0°C) | 9,5 (0°C) | 5,40 | 9,81 (0°C) |
| электросопротивление, | | | | | (25°C) | |
| ом×см․10-6 (или ом×см․10-8) | | | | | | |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Температурный | 44,9․10-4 | 45,7․10-4 | 37,7․10-4 (0- | 42․10-4 | 39,25․10-4 | 39,23․10-4 |
| коэффициент | (0-100°C) | (0-100°C) | 100°C) | (0-100°C) | (0-100°C) | (0-100°C) |
| электросопротивления | | | | | | |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Модуль нормальной | 47200 | 32000 | 12600 | 58000 | 52000 | 17330 |
| упругости, кгс/мм2** | | | | | | |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Твёрдость по Бринеллю, | 220 | 139 | 49 | 400 | 164 | 47 |
| кгсlмм2 | | | | | | |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Предел прочности при | - | 48 | 18,5 | - | 23 | 14,3 |
| растяжении, кгс/мм2 | | | | | | |
|---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Относительное удлинение | - | 15 | 24-30 | - | 2 | 31 |
| при разрыве, \% | | | | | | |
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
* Для Ru обнаружены полиморфные превращения при температурах 1035, 1190 и 1500°С.
** Все механические свойства даны для отожжённых П. м. при комнатной температуре; 1 кгс/мм2 = 10 Мн/м2. Некоторые параметры не приводятся как установленные неточно.
Применение. Из всех П. м. наибольшее применение имеет Pt. До 2-й мировой войны 1939-45 свыше 50\% Pt служило для изготовления ювелирных изделий. В последние 2-3 десятилетия около 90\% Pt потребляется для научных и промышленных целей. Из Pt делают лабораторные приборы - тигли, чашки, термометры сопротивления и др., - применяемые в аналитических и физико-химических исследованиях. Около 50\% потребляемой Pt (частично в виде сплавов с Rh, Pd, lr, см.
Платиновые сплавы) применяют как катализаторы в производстве азотной кислоты окислением NH
3, в нефтехимической промышленности и мн. др. Pt и её сплавы используются для изготовления аппаратуры для некоторых химических производств. Около 25\% Pt расходуется в электротехнике, радиотехнике, автоматике, телемеханике, медицине. Применяется Pt и как антикоррозионное покрытие (см.
Платинирование)
. lr применяют главным образом в виде сплава Pt + 10\% lr. Из такого сплава сделаны международные эталоны метра и килограмма. Из него изготовляют тигли, в которых выращивают кристаллы для лазеров, контакты для особо ответственных узлов в технике слабых токов. Из сплава lr с Os делают опоры для стрелок компасов и др. приборов.
Способностью сорбировать H2 и катализировать многие химические реакции обладает Ru; он входит в состав некоторых сплавов, обладающих высокой твёрдостью и стойкостью против истирания и окисления.
Rh благодаря своей способности отражать около 80\% лучей видимой части спектра, а также высокой стойкости против окисления является хорошим материалом для покрытия рефлекторов прожекторов и зеркал точных приборов. Но главная область его применения - сплавы с Pt, из которых изготовляют лабораторную и заводскую аппаратуру, проволоку для термоэлектрических пирометров (См.
Пирометры) и др.
Pd в виде черни применяется преимущественно как катализатор во многих химических производствах, в частности в процессах гидрогенизации (См.
Гидрогенизация)
. Из Pd изготовляют ювелирные изделия. Раствор H
2[PdCl
4] - чувствительный реактив на окись углерода. Полоска бумаги, пропитанная им, чернеет уже при содержании 0,02
мг/л СО в воздухе вследствие выделения Pd в виде черни по реакции:
H2[PdCI4] +H2O + CO = 4HCI + CO2 + Pd.
Аффинаж П. м. сопровождается выделением ядовитых Cl2 и NOCI, что требует хорошей вентиляции и возможной герметизации аппаратуры. Пары легколетучих RuO4 и OsO4 вызывают общее отравление, а также тяжёлые поражения дыхательных путей и глаз (вплоть до потери зрения). При попадании этих соединений на кожу она чернеет (вследствие восстановления их до RuO2, OsO2, Ru или Os) и воспаляется, причём могут образоваться трудно заживающие язвы. Меры предосторожности: хорошая вентиляция, резиновые перчатки, защитные очки, поглощение паров RuO4 и OsO4 растворами щелочей.
Лит.: Некрасов Б. В., Основы общей химии, т. 3, М., 1970, с. 170-204; Рипан P., Четяну И., Неорганическая химия, т. 2, Химия металлов, пер. с рум., М., 1972, с. 615-675; Плаксин И. Н., Иридий, в кн.: Краткая хим. энциклопедия, т. 2, М., 1963; Леонова Т. Н., Осмий, Палладий, там же, т. 3, М., 1964; её же, Платина, Родий, Рутений, там же, т. 4, М., 1965; Химия рутения, М., 1965; Федоров И. А., Родий, М., 1966; Звягинцев О. Е., Аффинаж золота, серебра и металлов платиновой группы, 3 изд., М., 1945; Черняев И. И., Комплексные соединения переходных металлов, М., 1973; Аналитическая химия платиновых металлов, М., 1972; "Известия Сектора платины и других благородных металлов", в. 1-32, Л. - М., 1920-1955 (в. 1-3 вышли под заглавием "Известия Института по изучению платины и других благородных металлов"); Platinum group metals and compounds. Wash., 1971.
С. А. Погодин.
В организме П. м. представлены главным образом элементом рутением, а также искусственными радиоизотопами рутения и родия. Морские и пресноводные водоросли концентрируют радиоизотопы рутения в сотни и тысячи раз (по сравнению со средой), ракообразные - в десятки и сотни, моллюски - до десятков, рыбы и головастики лягушек - от единиц до сотен.
106Ru интенсивно мигрирует в почве, накопляясь в корнях наземных растений. У наземных млекопитающих радиоизотопы Ru всасываются через пищеварительный тракт, проникают в лёгкие, отлагаются в почках, печени, мышцах, скелете. Радиоизотопы Ru - составная часть радиоактивного загрязнения (См.
Радиоактивное загрязнение) биосферы.
Лит.: Булдаков Л. А., Москалев Ю. И., Проблемы распределения и экспериментальной оценки допустимых уровней Cs137, Sr90 и Ru106, М., 1968.
Г. Г. Поликарпов.


![[[Рутений]] [[Рутений]]](https://commons.wikimedia.org/wiki/Special:FilePath/Ruthenium crystals.jpg?width=200)
![[[Родий]] [[Родий]]](https://commons.wikimedia.org/wiki/Special:FilePath/Rhodium powder pressed melted.jpg?width=200)
![[[Осмий]] [[Осмий]]](https://commons.wikimedia.org/wiki/Special:FilePath/Osmium-crystals 2.jpg?width=200)
![[[Иридий]] [[Иридий]]](https://commons.wikimedia.org/wiki/Special:FilePath/Iridium-2.jpg?width=200)
![[[Платина]] [[Платина]]](https://commons.wikimedia.org/wiki/Special:FilePath/Platinum crystals.jpg?width=200)
